식품의약품안전처(처장 김강립)와 관세청(청장 노석환)은 코로나19 K-방역 체계에서 중추적인 역할을 하고 있는 코로나19 진단시약의 허가와 수출현황 등을 공개하였습니다.
국내 코로나19 진단시약 정식허가 현황
식약처는 현재까지(12.3. 기준) 국내 코로나19 진단 등을 위해 총 9개(유전자 7개, 항원 1개, 항체 1개) 제품을 정식허가 하였습니다.
유전자 진단시약은 코로나19 감염자 확진을 위한 제품(6개)과 기침, 인후통 및 발열 등 증상이 비슷해 구분이 쉽지 않은 코로나19와 인플루엔자를 동시에 진단할 수 있는 제품(1개)이 있으며,
유전자 진단에 비해 정확도는 부족하지만 신속하게 바이러스 유무를 확인할 수 있는 항원 진단시약 1개와 코로나19 바이러스에 대한 항체 존재여부를 확인 할 수 있는 항체 진단시약 1개가 있습니다.
검체(비인두 도말)로부터 코로나19 바이러스의 특정 단백질을 검출하여 바이러스 감염 여부를 확인하는 방식으로 30분 내에 검사 가능하며, 증상이 있는 사람에게만 사용해야 하고, 유전자 진단시약 검사 결과와 임상증상 등을 고려하여 의사가 감염 여부를 최종 판단
아울러, 현재(12.3. 기준) 정식허가를 신청한 진단시약은 유전자 진단시약 18개, 항원 진단시약 7개, 항체 진단시약 15개로 총 40개 제품이 심사 중에 있습니다.
코로나19 진단시약 생산‧공급 현황
국내 방역에 사용 중인 코로나19 진단시약의 1일 최대 생산량은 약 59만명분이고, 현재까지 558만명분을 생산하여 이중 475만명분을 공급되었고(12.3 기준) 지금까지 총 313만건의 검사(질병관리청 통계)를 진행하였습니다.
현재 확보된 재고 약 83만명분은 최근 일주일 동안 1일 평균 검사량 2만명분을 감안하였을 때 약 한달 이상 의료현장에 공급할 수 있는 물량으로 안정적인 수급을 이어가고 있습니다.
코로나19 진단시약 수출 현황
수출용 코로나19 진단시약은 현재 221개 제품(유전자 105, 항원 44, 항체 72)이 수출용 제품으로 허가되어, 전 세계 170여개 국가로 총 4억 9,679만명분이 수출(11.30 기준) 되었습니다.
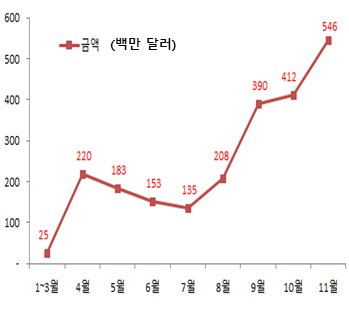
관세청은 금년 초부터 ‘20.11월까지 총 수출금액이 약 2조5천억원(22억7천만 달러)으로 수출이 급증하고 있다고 밝혔습니다.
4월부터 본격적으로 시작된 수출은 7월 이후 확진자 급증에 따라 가파른 상승세를 보였으며 10월과 11월에 연이어 수출 최고치(월별 기준)를 경신하였습니다.
< 코로나19 진단시약 수출 및 세계 확진자 추이 (누적기준) >

(단위: 백만달러, 백만명)
구분 | 1~3월 | 4월 | 5월 | 6월 | 7월 | 8월 | 9월 | 10월 | 11월 |
수출 금액* | 월별 | 25 | 220 | 183 | 153 | 135 | 208 | 390 | 412 | 546 |
누적 | 25 | 245 | 428 | 581 | 716 | 923 | 1,314 | 1,726 | 2,272 |
누적확진자 | 0.9 | 3 | 6 | 10 | 18 | 25 | 34 | 46 | 63 |
* 수출용 허가(식약처)와 수출신고 내역(관세청)을 비교ㆍ집계하여 실제 실적과 차이가 있을 수 있음
수출용 허가(식약처)와 수출신고 내역(관세청)을 비교ㆍ집계하여 실제 실적과 차이가 있을 수 있음
수출 국가별로 보면, 인도(15.6%), 독일(13.2%), 네덜란드(9.6%), 이탈리아(7.8%), 미국(5.2%) 등으로 상위 5개 국가가 전체 수출액의 50% 이상을 차지하고 있으며,수출 국가도 1~3월 83개 국가에서 11월까지 총 170여개 국가로 지속적으로 확대되었습니다.
이러한 코로나19 진단시약 수출실적은 금년에 새롭게 창출된 수출 성과로서, “국제적으로 팬데믹대응의 모범으로 인정받은 K-방역에 대한 인식과 우수한 인프라를 통해 개발된 국내 제품의 우수성이 함께 작용한 것”으로 평가됩니다.
감염병 진단기법 국제표준화기구(ISO) 국제표준 제정
우리나라가 제안한 코로나19 등 감염병 진단기법이 국제표준화기구(ISO)의 국제 표준(International Standard)으로 12월 2일 제정되었습니다.
코로나19 등 감염병 진단기법의 국제표준명
(국문명) 체외진단 시험 시스템 – 미생물 병원체의 검출 및 식별을 위한 핵산증폭기반 체외진단 검사 절차 - 검사실 품질적용 가이드(ISO 17822)
(영문명) In vitro diagnostic test systems — Nucleic acid amplification-based examination procedures for detection and identification of microbial pathogens — Laboratory quality practice guide(ISO 17822)
이번 국제표준 제정은 신종플루(‘09년), 메르스(’15년) 등 신종 감염병이 잇따라 유행하면서 감염병 진단 검사 관련 절차와 방법에 대한 표준화 필요성이 국내‧외에서 제기되는 가운데 우리나라에서 적극 추진되었습니다.
표준 감염병 진단기법은 ‘유전자 증폭방식’의 체외진단검사를 수행하는 검사실의 운영절차 및 방법을 정의한 것으로, 코로나19 진단키트에 적용된 실시간 유전자 증폭기법(Real Time Polymerase Chain Reaction) 등 다양한 감염병 진단검사에 적용할 수 있는 표준입니다.
이로써 향후 국내 진단시약의 국제 신뢰도가 한층 향상되고 국산 체외진단의료기기의 해외시장 확대에도 추진력을 받을 것으로 기대되고 있습니다.
식약처와 관세청은 코로나19 진단시약의 허가부터 수출까지 현황 등을 지속적으로 모니터링하고 있으며, 품질이 우수한 제품의 신속 개발·허가를 적극적으로 지원하고 새롭게 창출된 해외시장에서 ‘K-진단시약’의 경쟁력이 지속될 수 있도록 노력하겠다고 밝혔다.
이창희 기자 <저작권자 ⓒ 헤드라인코리아저널 무단전재 및 재배포금지>